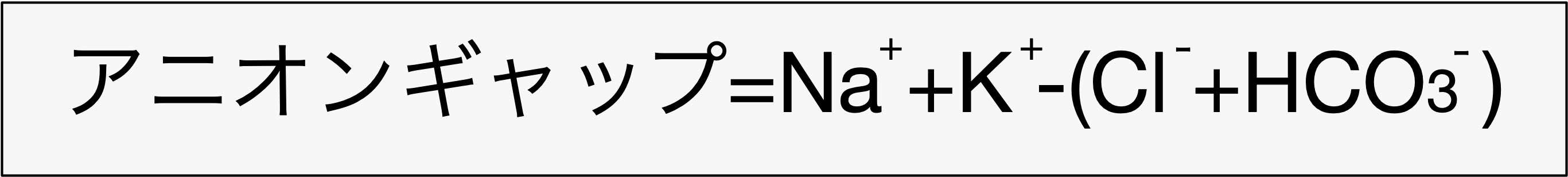疾患
代謝性アシドーシス
代謝性アシドーシス
pHは水素イオン濃度で決まる
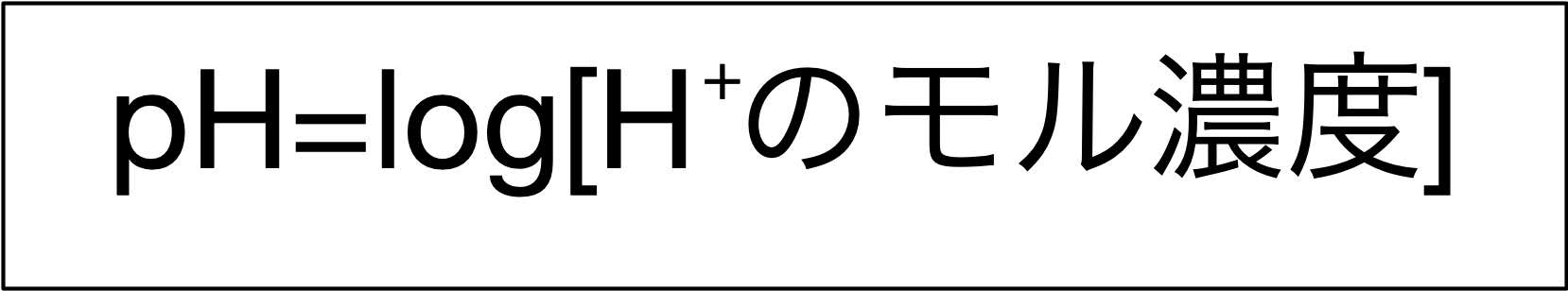
・酸としての強さは、水中に溶解した電解質の分子のうち、電離して水素イオンを放出するものの割合(電離度)で決まる
強酸 HCL(塩酸)、H2SO4(硫酸)
強アルカリ NaOH、KOHなど
【生体内での酸と塩基の分類】
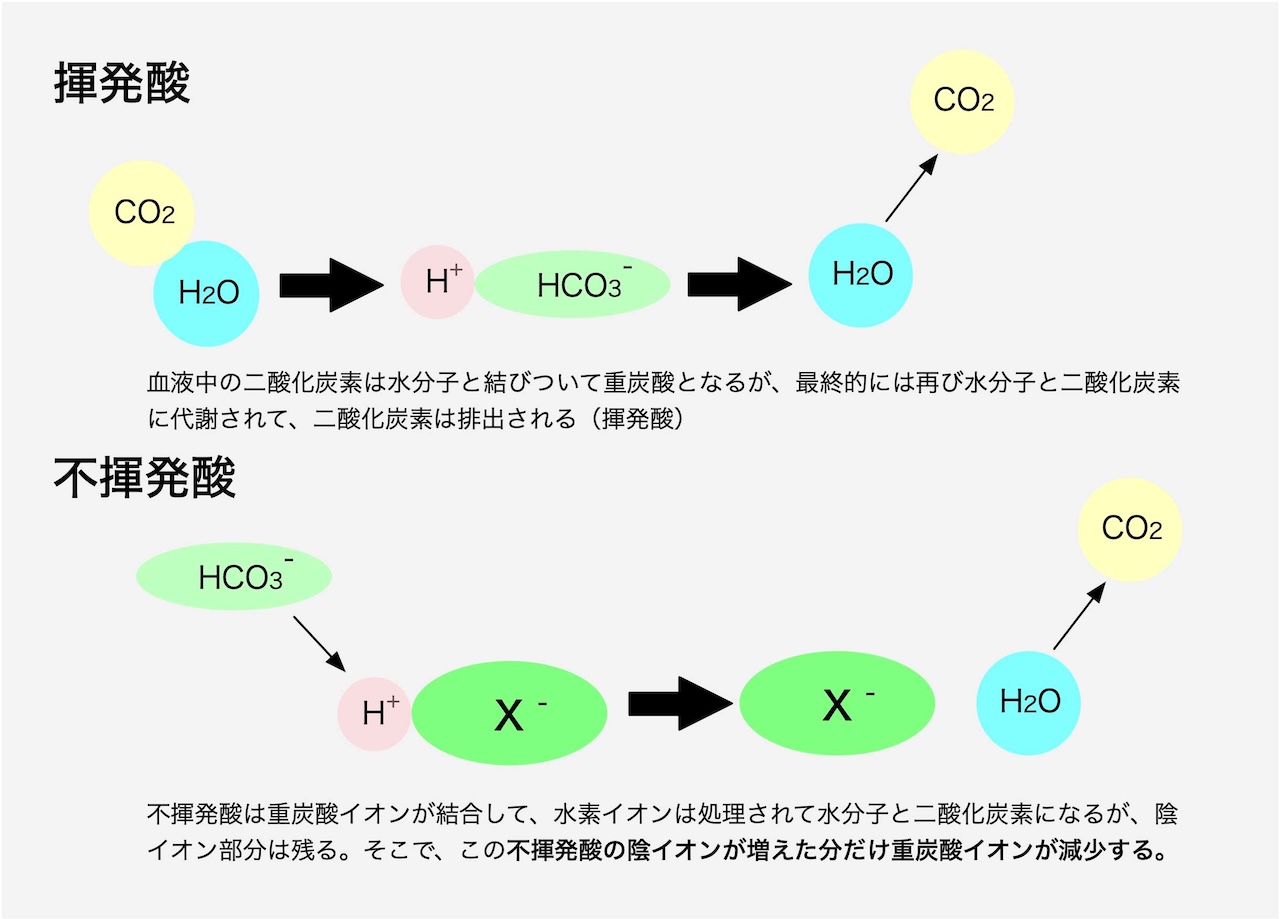
① 揮発酸と不揮発酸
揮発酸: H2CO3(炭酸)
・CO2はH2Oと反応して炭酸となるが、最終的には肺から排出されるので「揮発酸」と呼ばれる
不揮発酸: 乳酸、リン酸、硫酸、ケトン体など
② 塩基
・重炭酸イオンが50%強で、残りの大部分はヘモグロビン
【代謝性アシドーシスの分類】
・不揮発性酸が異常増加する場合と、重炭酸イオンが過剰に捨てられる場合がある

・重炭酸イオンが過剰に捨てられる場合には、塩素イオンが増加してバランスが保たれる
・不揮発酸が増加する場合には、重炭酸イオンが減少する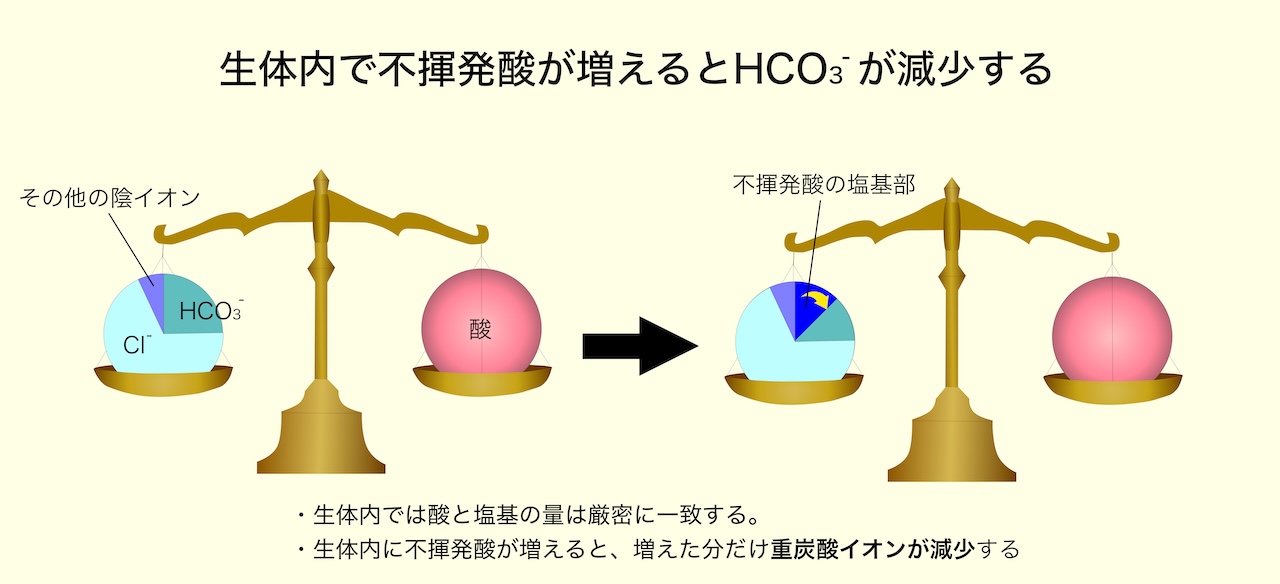
◎ 従って、生体内で不揮発酸が増加すると、アニオンギャップは開大する
-
参考文献)
1. 古川力丸,丹正勝久 編「血液ガスを各科でフレンドリーに使いこなす」レジデントノートvol.20 No.6 2108 羊土社
https://www.jaam.jp/dictionary/dictionary/word/0420.html
2. 浅野泰「 塩基平衡の基礎知識と動脈血ガス分析の読み方」日内会誌 86:1868~1872,1997
3. 増井伸高「POCTハンター」 中外医学社 2022